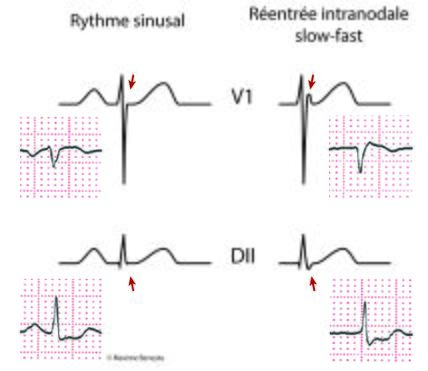
Tachycardie par réentrée intra-nodale
Rédacteur : Dr Maxime Beneyto (CHU de Toulouse). Relecteur : Dr Guillaume Domain (CHU de Toulouse).
Définition et mécanisme
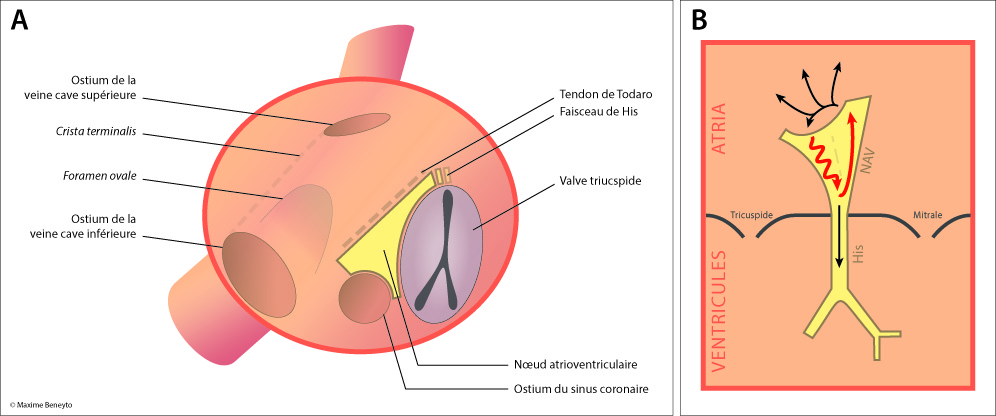
Il s’agit d’une tachycardie par réentrée. Celle-ci est rendue possible par une dualité nodale, c’est-à-dire que le nœud atrioventriculaire est divisé en (au moins) deux voies dont les propriétés électrophysiologiques sont différentes. Au cours de la tachycardie par réentrée intra-nodale, l’influx électrique va emprunter une voie dans le sens antérograde et une deuxième voie dans le sens rétrograde (Figure 1). La réentrée ne dépend que du nœud atrio-ventriculaire et peut donc théoriquement se poursuivre sans participation des ventricules (en cas de bloc intra- ou infra-hissien associé) ou des atria (des cas avec une conduction rétrograde en 2:1 ont été observés).[1] Ces cas sont extrêmement rares, on observe en règle générale une tachycardie avec une relation atrioventriculaire en 1:1.
Dans la dualité nodale, la voie rapide correspond à la voie normale empruntée par l’influx électrique en rythme sinusal ; elle conduit rapidement et a une période réfractaire longue. La voie lente, à l’inverse, conduit lentement et possède une période réfractaire plus courte. Elle peut rarement s’exprimer en rythme sinusal en cas de double réponse (Figure 2).[2] Il est important de noter que l’existence d’une dualité nodale est fréquente, environ 25% de la population générale,[3] mais seule une minorité des sujets qui en sont porteur développeront des épisodes de tachycardie par réentrée intra-nodale. La coexistence d’épisodes de tachycardie supraventriculaires et d’une dualité nodale ne suffit pas à affirmer qu’il s’agisse de tachycardies par réentrée intra-nodale.
La dénomination anglaise de cette tachycardie est atrioventricular nodal reentrant tachycardia (AVNRT).
Classification
Plusieurs types de tachycardies par réentrées intra-nodales existent ; elles sont caractérisées par les voies empruntées dans le sens antéro- et rétrograde.
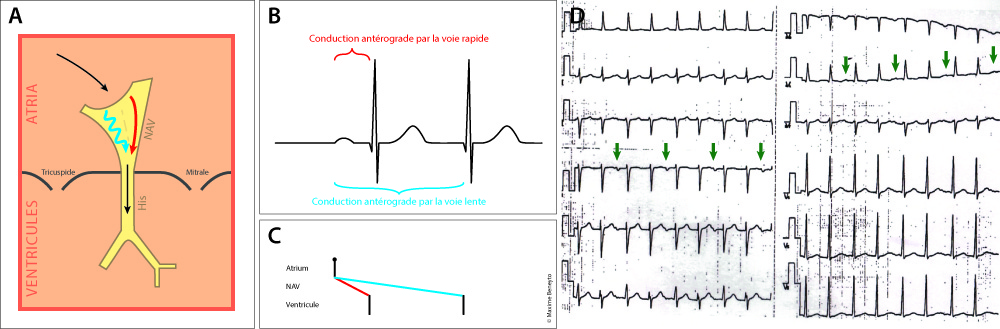
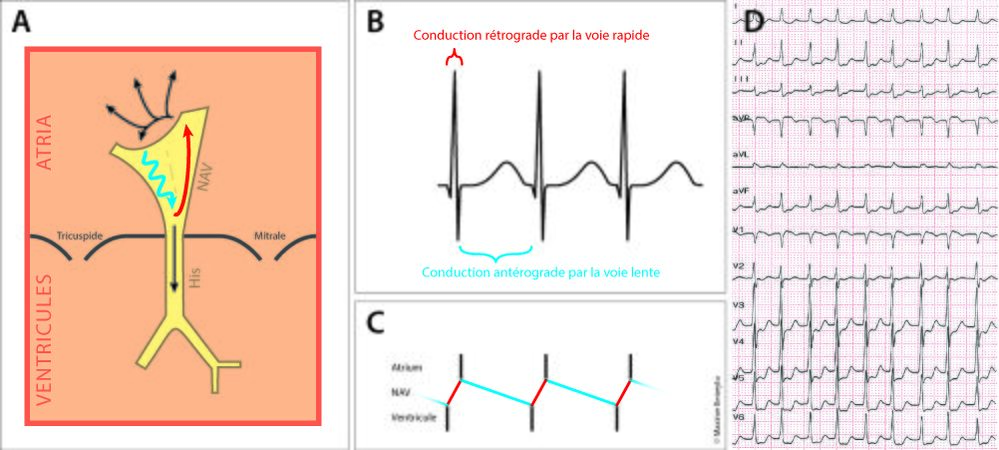
La tachycardie par réentrée intra-nodale typique est dite slow-fast. Cette dénomination indique respectivement la voie utilisée dans le sens antérograde et celle utilisée dans le sens rétrograde. L’influx électrique descend donc par la voie lente et remonte par la voie rapide (Figure 3).
Les tachycardies par réentrée intra-nodale atypiques sont de deux types :
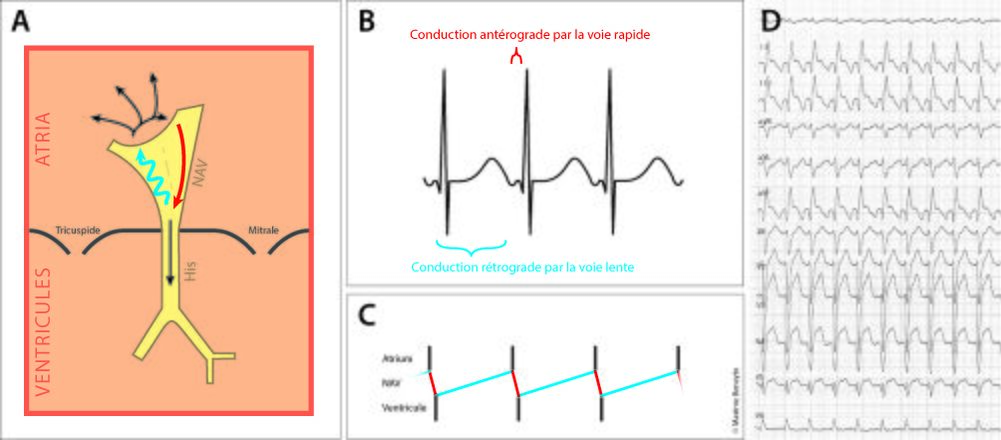
- La tachycardie par réentrée intra-nodale fast-slow où le trajet est inversé : descente par la voie rapide et remontée par la voie lente (Figure 4).
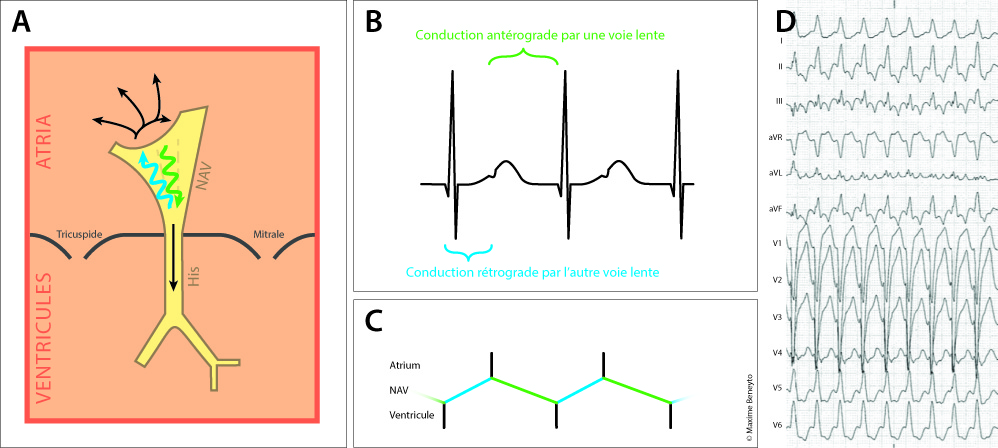
- La tachycardie par réentrée intra-nodale slow-slow dans laquelle il existe deux voies lentes, l’une servant à la descente, l’autre à la remontée (Figure 5).
Prévalence et démographie
Les tachycardies par réentrées intra-nodales représentent les tachycardies supraventriculaires paroxystiques les plus fréquentes (fibrillation atriale exclue).[4]
La distribution de l’âge des sujets atteints de tachycardies par réentrée intra-nodale est bimodale avec un premier pic vers 20 ans et un deuxième vers 40 ans.[5][6] Chez les jeunes patients, les premières crises surviennent vers la fin de l’adolescence puis se majorent, ce qui les pousse à consulter. Les femmes sont plus fréquemment concernées que les hommes.
Les tachycardies par réentrée intra-nodale surviennent dans la majorité des cas sur cœur sain.[4]
Les tachycardies par réentrée intra-nodale les plus fréquentes sont de type slow-fast (80% des cas).[5][7] Celles de type slow-slow sont les plus rares. Plus les patients sont âgés plus la prévalence des tachycardies par réentrée intra-nodale atypique augmente.[8]
Diagnostic
Description clinique
Au point de vue clinique, les patients présentent des crises de palpitations rapides, régulières, de début et de fin brutale. Elles peuvent être déclenchées par des variations brusques de la précharge comme l’inspiration brutale ou se pencher rapidement en avant. La moitié des patients présentant une tachycardie par réentrée intra-nodale typique se plaignent également de palpitations dans le cou. Ce « frog sign » est dû à la contraction de l’atrium droit sur la valve tricuspide fermée, engendrant un reflux sanguin dans les veines jugulaires.[5] Lorsque la crise se termine, les patients décrivent une sensation de soulagement, de vide, de chaleur et fréquemment une envie pressante d’uriner avec polyurie. De manière moins classique, certains patients peuvent se plaindre de douleur thoracique (oppression, pincement, etc.), de lipothymies ou de dyspnée. L’existence de syncopes véritables est possible mais rare et se rencontre essentiellement chez les sujets les plus âgés.
L’éventail de sévérité de la symptomatologie peut être très large, allant de crises de palpitations épisodiques de quelques battements aux tachycardies subintrantes ou incessantes.
Description électrocardiographique
A l’électrocardiogramme, la tachycardie est régulière, à QRS fins (sauf aberration de conduction ou bloc de branche préexistant, cf. Figure 4 et Figure 5). La fréquence est habituellement entre 180 et 240 bpm, mais elle est bien plus lente dans les tachycardies slow-slow (les deux voies étant lentes, le cycle de la tachycardie est nécessairement plus long).
L’onde P est nécessairement rétrograde, c’est-à-dire négative dans les dérivations inférieures (lorsqu’elle est visible) et positive en V1. Etant donné qu’elle naît du nœud atrioventriculaire, l’onde P dépolarise les atria droit et gauche simultanément ; sa durée est donc moindre que celle de l’onde P en rythme sinusal. La position de l’onde P rétrograde par rapport à l’intervalle RR renseigne sur le type de tachycardie par réentrée intra-nodale.
Dans les mécanismes slow-fast, la tachycardie est à RP’ très court, <90ms.[3] Bien souvent, elle n’est pas visible car elle est fondue dans le QRS (Figure 3). Elle peut être démasquée en comparant la morphologie du QRS en tachycardie et en rythme sinusal. En effet, dans la dérivation V1 en tachycardie, on peut déceler une pseudo-onde R’, inexistante en rythme sinusal, qui correspond à l’onde P rétrograde. Cela correspond au shoulder sign, également appelé « signe de Wellens ». De manière similaire, l’onde P peut être prise pour une onde s dans les dérivations inférieures, qui sera là encore absente en rythme sinusal (Figure 6).[9]
Dans les formes atypiques fast-slow (Figure 4), le RP’ est long, l’onde P rétrograde se trouve dans la deuxième moitié de l’intervalle RR, avant le QRS. Dans les tachycardies slow-slow (Figure 5), le RP’ est plus court (néanmoins >90ms), l’onde P rétrograde se trouve vers le milieu de l’intervalle RR ou dans la pente ascendante de l’onde T.
Les tachycardies sont déclenchées par des extrasystoles atriales ou plus rarement des extrasystoles ventriculaires.
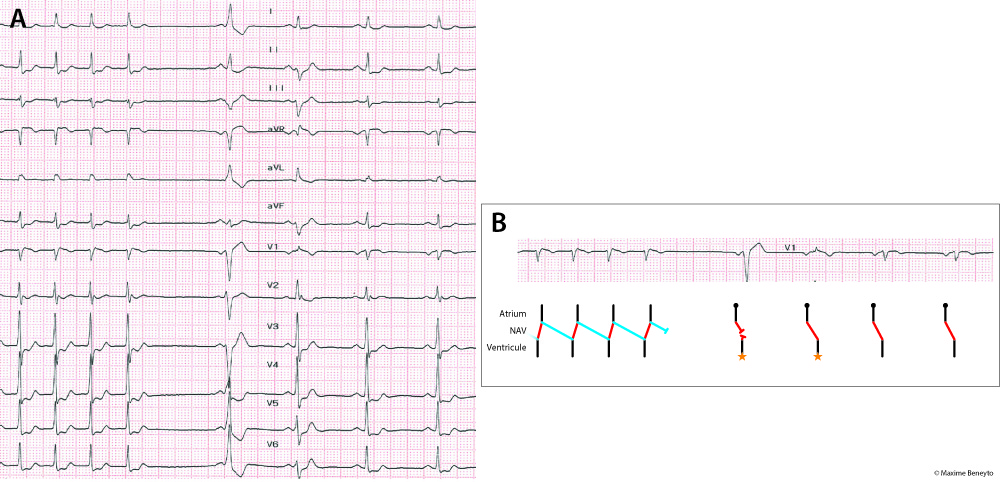
Elles s’interrompent le plus souvent par une modification des propriétés électrophysiologiques de la voie rapide qui finit par bloquer le passage de l’influx électrique. Dans le cas d’une tachycardie par réentrée intra-nodale typique, la tachycardie s’arrête de manière caractéristique sur une onde P rétrograde (Figure 7). L’arrêt de la tachycardie sur un complexe QRS fera d’avantage évoquer une tachycardie atriale, sans pouvoir éliminer un mécanisme de réentée.
L’arrêt de la tachycardie peut être spontané ou provoqué. Dans ce dernier cas, il sera obtenu par la réalisation de manœuvres vagales ou l’administration de médicaments. Ces différentes options seront détaillées dans la section « Traitement ». L’efficacité de ces mesures n’est pas pathognomonique du diagnostic de tachycardie jonctionnelle mais reste très évocatrice. L’existence d’une préexcitation ventriculaire sous l’effet de l’adénosine pourra nous orienter, vers une réentrée sur voie accessoire.
L’ECG en rythme sinusal est strictement normal (en l’absence de pathologie associée).
Description électrophysiologique endocavitaire
L’exploration électrophysiologique des tachycardies par réentrées intra-nodale se fait idéalement à l’aide de trois cathéters (sinus coronaire, faisceau de His et ventricule droit) (Figure 8). Il peut être utile de positionner une sonde décapolaire dans le sinus coronaire dans l’éventualité d’un diagnostic différentiel de voie accessoire. L’utilisation d’un système de navigation et de cartographie tridimensionnel a peu d’intérêt pour le diagnostic des cas classiques.

Exploration en rythme sinusal
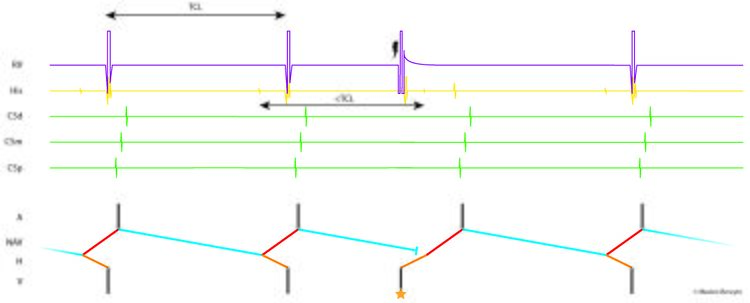
Lorsque l’exploration a lieu en rythme sinusal, elle va avoir pour objectif premier de démontrer l’existence d’une dualité nodale. C’est le cas lorsqu’un extrastimulus atrial permet d’allonger l’intervalle AV (plus exactement l’intervalle AH) de plus de 50 ms alors qu’il n’est plus précoce que l’extrastimulus du train de stimulation précédent que de 10 (ou 20) ms. C’est ce qu’on appelle un saut de conduction antérograde (Figure 9). Un saut de conduction rétrograde peut plus rarement être démontré dans les mêmes conductions mais avec des extrastimuli ventriculaires. Ces sauts correspondent à un blocage de l’influx électrique dans la voie rapide avec un passage abrupt sur la voie lente.

Un autre signe très évocateur de l’existence d’une dualité nodale est la capacité d’une stimulation atriale à fréquence croissante à repousser progressivement le ventriculogramme au-delà de la stimulation atriale suivante. On observe alors un intervalle PR plus long que l’intervalle RR (cross over, Figure 10).
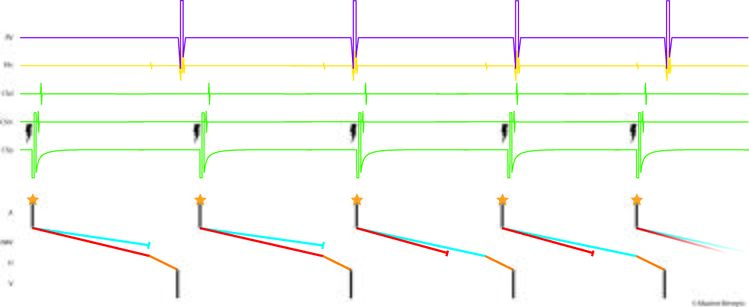
Il est très important de souligner que l’existence d’une dualité nodale est fréquente dans la population générale (environ 25% des sujets) ;[3] l’écrasante majorité de ces sujets ne développera jamais de tachycardie. Par conséquent, la simple existence d’une dualité nodale ne permet pas en soi d’affirmer le mécanisme par réentrée intra-nodale d’une tachycardie supraventriculaire. L’exploration électrophysiologique doit être rigoureuse pour ne pas passer à côté d’un diagnostic différentiel.
Dans les cas typiques, le saut de conduction s’accompagne d’un écho, c’est-à-dire d’un signal atrial concomitant au signal ventriculaire, témoin d’une remontée par la voie rapide. Il n’est pas rare que cela suffise à engendrer la tachycardie (Figure 11). Des échos rétrogrades sont également possibles.

La stimulation parahissienne montre une réponse nodale, c’est-à-dire un allongement de l’intervalle VA à la perte de capture hissienne (obtenue par diminution de la tension de stimulation, Figure 12).

L’induction des tachycardies se fait par l’administration d’un ou plusieurs extrastimuli atriaux. L’objectif est de bloquer la voie rapide pour emprunter la voie lente dans le sens antérograde et initier la réentrée. Il faut parfois recourir à l’isoprénaline pour moduler les propriétés de conduction respectives de la voie lente et de la voie rapide et obtenir les conditions favorables à la réentrée. Dans de rare cas les extrastimuli ventriculaires vont permettre de déclencher la réentrée.
Exploration en tachycardie
Lors de l’exploration électrophysiologique endocavitaire en tachycardie, on observe le plus souvent un rapport en 1:1 entre l’activité atriale et ventriculaire.
Du fait du mécanisme réentrant, les variations de l’intervalle HH précèdent celles de l’intervalle AA.
Pour les tachycardies par réentrée intra-nodale typique, l’activation atriale est concentrique (elle débute par l’auriculogramme hissien, se propage de la partie proximale vers la partie distale du sinus coronaire ; elle se propage en parallèle en remontant le long de la paroi latérale de l’atrium droit). L’intervalle VA (entre le ventricule « V » et l’activité atriale « A ») est très court sur le cathéter hissien (<60ms, parfois négatif) (Figure 13, Figure 14).
Pour les tachycardies par réentrée intra-nodale atypiques, l’intervalle VA est long (Figure 13).

Manœuvres d’entrainement
La manœuvre d’entrainement principale dans le diagnostic différentiel des tachycardies supraventriculaires est l’entraînement ventriculaire en tachycardie. Un train de stimulation est délivré à l’aide du cathéter placé dans le ventricule droit avec un cycle plus court de 10 à 20 ms à celui de la tachycardie.
A l’arrêt de cet entraînement ventriculaire, on observe une réponse VAV (plus précisément VAHV). Cela distingue les tachycardies par réentrée intra-nodale des tachycardies atriales, ces dernières présentant une réponse VAAV (Figures 15 et 16).
L’intervalle entre la dernière stimulation ventriculaire et le premier signal recueilli sur la sonde ventriculaire à l’arrêt de l’entraînement (PPI, Post Pacing Interval) est long (supérieur de plus de 110 ms au cycle de la tachycardie, après correction de l’allongement de l’intervalle AH par la stimulation) car le ventricule ne fait pas partie du circuit. Le délai entre la stimulation ventriculaire et le recueil du signal atrial dans le sinus coronaire (intervalle S-A) est plus long que le délai entre le signal ventriculaire et le signal atrial en tachycardie (intervalle V-A) car l’activation du ventricule et de l’atrium est séquentielle pendant l’entraînement ventriculaire alors qu’elle est quasi simultanée en tachycardie (différence entre S-A et V-A >85 ms) (Figures 15 et 16).
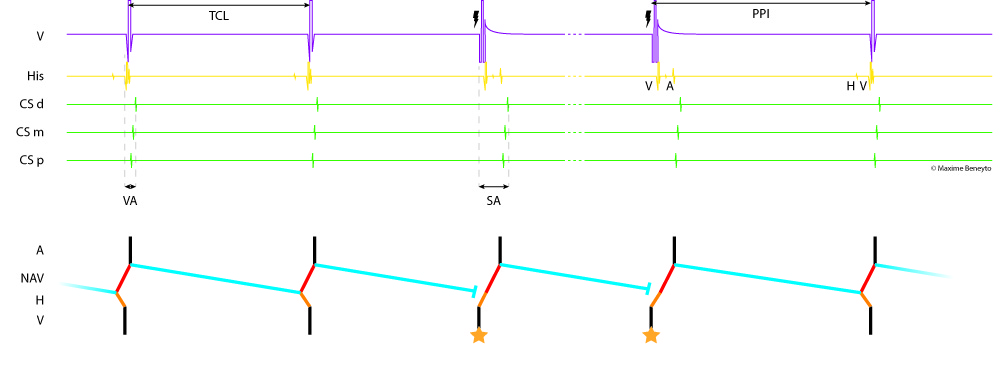

L’initiation de l’entraînement ventriculaire est également utile au diagnostic de la tachycardie. Dans une réentrée intra-nodale, le ventricule ne faisant pas partie du circuit, il est nécessaire d’avoir plusieurs stimulations ventriculaires (avec capture complète) avant que l’influx ne pénètre le NAV (et donc le circuit de la tachycardie) et n’aboutisse à un entrainement de celle-ci. Cette caractéristique distingue les réentrées intra-nodales des réentrées sur voie accessoire où le ventricule fait partie du circuit. (Figure 17).
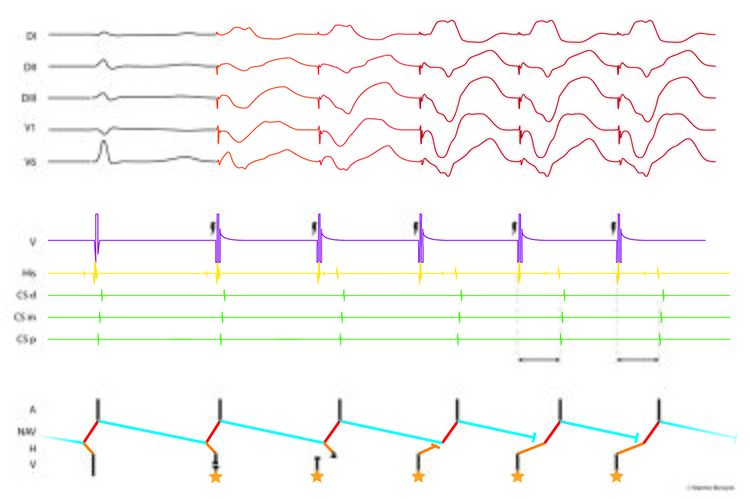
Un entraînement atrial peut également être délivré en tachycardie. A l’arrêt de celui-ci, l’intervalle VA est constant ou presque (<14 ms), que la stimulation soit effectuée sur la partie haute de l’oreillette droite ou la partie proximale du sinus coronaire. Cette caractéristique distingue la tachycardie par réentrée intra-nodale d’une tachycardie atriale pour laquelle il n’y a pas de circuit de réentrée. Il n’y a donc pas de lien entre le potentiel ventriculaire et le potentiel atrial suivant ; l’intervalle VA à l’arrêt de l’entrainement atrial sera variable et dépendant de la fréquence de stimulation atriale et de sa localisation par rapport au foyer de la tachycardie.
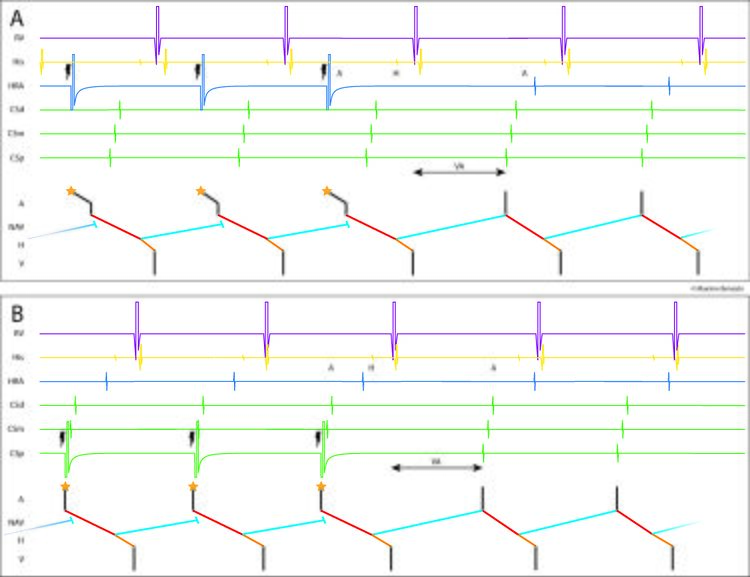
Extrastimuli ventriculaires et atriaux en tachycardie
Les battements ventriculaires prématurés (spontanés ou provoqués) peuvent recycler la tachycardie, ils avancent alors le potentiel hissien suivant et ne modifient pas la séquence d’activation atriale (Figure 19).
Les extratimuli ventriculaires en période réfractaire du His n’ont aucun effet sur la tachycardie puisqu’ils ne peuvent pas pénétrer le circuit de celle-ci (Figure 20).
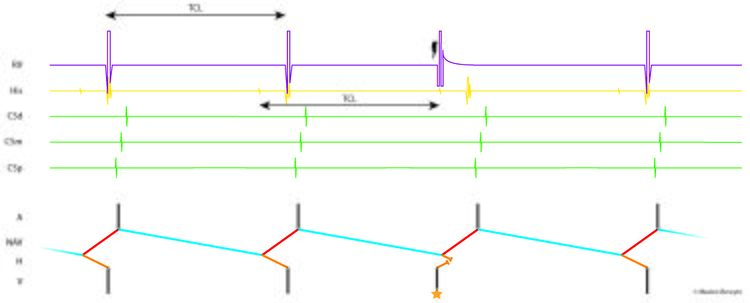
Les extrasystoles ou extrastimuli atriaux tardifs en tachycardie n’atteignent pas le nœud atrioventriculaire et n’avancent pas le potentiel hissien ni le potentiel ventriculaire (Figure 21) ; elles peuvent en revanche retarder l’émergence de l’activité atriale suivante.

Lorsqu’elles n’interrompent pas la tachycardie, les extrasystoles ou extrastimuli atriaux précoces n’ont pas d’effet sur le potentiel hissien survenant immédiatement après (contrairement aux tachycardies jonctionnelles automatiques) mais avancent le potentiel hissien suivant. La précocité de ce potentiel hissien est moindre que celle de l’extrastimulus atrial du fait des propriétés de conduction décrémentielle du nœud atrioventriculaire (Figure 22).

Dans les cas simples, l’entraînement ventriculaire suffit au diagnostic : la réponse VA(H)V élimine la tachycardie atriale, le PPI et le SA-VA longs écartent la tachycardie orthodromique.
L’émergence atriale de la voie lente se situe habituellement sur le bord antérieur du sinus coronaire. Outre cette localisation habituelle, deux autres localisations de voie lente ont été décrites, avec un impact sur le geste d’ablation (Figure 23).
Traitement
Traitement aigu
Le principe du traitement aigu est de bloquer la conduction atrioventriculaire dans la voie rapide pour arrêter la réentrée.
Cet objectif peut être atteint à l’aide de manœuvres vagales diverses réalisées par le patient : efforts de toux, réalisation du poirier, succion de glaçons, manœuvre de Valsalva (expiration forcée à bouche fermée pour augmenter la pression intrathoracique et stimuler le baroréflexe). Ces manœuvres ont souvent été tentées sans succès par les patients présentant des crises récurrentes. Elles peuvent être enseignées aux patients qui ne les connaissent pas.
Des manœuvres vagales peuvent être réalisées par le médecin : massage sinocarotidien (dans la mesure du possible on s’assurera d’absence d’athérome carotidien menaçant chez les sujets à risque avant d’initier le massage), compression oculaire (peu pratiquée) ou encore manœuvre de Valsalva inversée (voir la publication d’Appelboam et al.).[12]
En seconde intention, lorsque ces manœuvres ont échoué, l’adénosine peut être utilisée (20 mg en intraveineuse flash). Ce médicament est très efficace, il arrête la conduction atrioventriculaire et donc la tachycardie. S’il révèle une préexcitation, il faut plutôt évoquer le diagnostic de réentrée atrioventiculaire sur voie accessoire. L’adénosine est souvent responsable d’une pause sinusale qui peut être impressionnante mais sans gravité, avec une récupération rapide. Demander au patient de tousser peut permettre d’accélérer cette récupération. Il faut noter que l’adénosine est très désagréable pour les patients ; ils décrivent une sensation d’étouffer, des bouffées de chaleur et une sensation de « partir ». L’adénosine est contre-indiquée chez les patients asthmatiques. Par précaution, elle ne doit être administrée qu’en milieu hospitalier avec une surveillance ECG continue et à proximité d’un chariot d’urgence.
Lorsque la tachycardie résiste à l’adénosine ou récidive peu après, on peut administrer un inhibiteur calcique bradycardisant intraveineux (ou un bêtabloquant). Dans ces cas il faudra surtout remettre en question le diagnostic de tachycardie par réentrée intra-nodale.
Traitement chronique
Le traitement au long cours va essentiellement dépendre de la gêne du patient (durée des crises et intensité des symptômes pendant la crise) et de la fréquence des accès de tachycardie. En effet, il s’agit d’une tachycardie totalement bénigne, l’objectif du traitement sera uniquement de soulager la symptomatologie du patient.
Pour les crises peu fréquentes et peu invalidantes, l’abstention thérapeutique est le plus souvent la règle, en enseignant au patient quelques manœuvres vagales.
En cas de crises peu fréquentes mais prolongées, un traitement par inhibiteur calcique bradycardisant à libération immédiate à la demande peut être proposé mais cela implique que le patient supporte sa crise jusqu’à ce que l’absorption digestive du traitement soit effective et qu’il se révèle efficace (soit 20 à 60 minutes).
Lorsque les crises sont plus fréquentes et/ou invalidantes, le traitement de choix est l’ablation par cathéter.
Chez les patients réticents à cette prise en charge, on peut proposer un traitement au long cours par bêtabloquant ou inhibiteur calcique bradycardisant. Ce traitement n’est cependant efficace que dans 30 à 60 % des cas.
Après un échec du traitement médical de première ligne, lorsque le patient refuse catégoriquement une procédure d’ablation, on peut proposer en deuxième ligne un traitement par flécainide ou propafénone (sous réserve de l’absence de cardiopathie). Si ce traitement échoue, il faudra alors se résoudre à prescrire des traitements possédant des effets indésirables significatifs (ce qui devrait plutôt faire reconsidérer l’ablation) : sotalol, dofétilide, amiodarone ou digoxine (ce dernier ayant peu de chances d’être efficace du fait du contexte orthosympathique des tachycardies).
L’objectif de l’ablation par cathéter est de détruire la voie lente, tout en préservant la voie rapide. Dans la plupart des cas, elle est réalisée dans la suite de l’exploration électrophysiologique qui confirme le diagnostic. La procédure est donc pratiquée sur un patient en décubitus dorsal sur la table d’électrophysiologie, relié à un ECG 12 dérivations et sous surveillance tensionnelle et de la saturation en oxygène. Sous anesthésie locale, une ponction veineuse fémorale droite (de préférence échoguidée) est réalisée pour permettre d’amener les cathéters diagnostiques et d’ablation jusqu’au cœur via la veine cave inférieure. L’anesthésie locale peut être complétée par une anxiolyse et une antalgie par voie générale. Les procédures sous anesthésie générale sont exceptionnelles.
Le cathéter d’ablation est positionné avant tout sur des critères anatomiques : en avant du sinus coronaire (vers l’anneau tricuspidien) et en caudal du faisceau de His (Figure 24). Si l’ablation échoue à cet endroit, on peut cibler le toit du sinus coronaire, après avoir pénétré celui-ci de 1 à 3 cm (cela correspond à l’extension inférieure gauche du nœud atrioventriculaire). Dans de rare cas, il faut délivrer l’ablation à gauche, à la partie postérieure du septum inter-atrial, près de l’anneau mitral. Les sites où l’ablation se révèle efficace ont généralement un rapport d’amplitude des signaux atriaux et ventriculaires entre 0.5 et 0.8.
On peut également chercher des critères électrographiques comme le potentiel de Jackman (aigu et bref, indiquant la connexion atriale de la voie lente)[13] ou le potentiel plus long et plus mousse décrit par Haïssaguerre.[14]
Dans le cas de réentrées intra-nodales atypiques, l’utilisation d’un système de cartographie et de navigation tridimensionnel permet d’observer l’émergence atriale de l’influx électrique rétrograde en tachycardie et de réaliser une ablation ciblée. Dans le cas des réentrées de type slow-slow, cette émergence s’observe plutôt à la partie antérieure de l’ostium du sinus coronaire.
L’ablation peut être réalisée par deux énergies différentes : la cryoablation (« le froid ») ou la radiofréquence (« le chaud »). Le choix dépend principalement des habitudes de l’opérateur.
Par radiofréquence, à l’aide d’un cathéter orientable non irrigué, on va chercher à appliquer une puissance de 30 à 50 W pendant 30 à 60 secondes à l’endroit sus-décrit. La délivrance de la radiofréquence génère souvent dans les 10 – 20 premières secondes un rythme jonctionnel actif lent (prédictif du succès d’ablation, Figure 25) au cours duquel il est impératif de vérifier la survenue d’un signal atrial systématique (son absence suggère la possibilité d’un bloc atrioventriculaire débutant et doit faire cesser l’ablation immédiatement sous peine de lésions irréversibles). Un rythme jonctionnel actif rapide évoque quant à lui une atteinte du faisceau de His, suggérant qu’une bloc atrioventriculaire complet est imminent et imposant là encore l’arrêt immédiat du tir d’ablation. L’ablation par radiofréquence jouit d’un taux de succès de près de 95%. L’impossibilité de réinduire une tachycardie est un critère de succès de l’ablation ; on peut tolérer la persistance d’un écho unique. L’ablation de la voie lente améliore souvent les propriétés de conduction de la voie rapide et l’intervalle AH est plus court en fin qu’en début de procédure.
Par cryoablation, on va appliquer une température de -75°C pendant 4 min. Cette énergie n’engendre pas de rythme jonctionnel ; on réalise alors une stimulation atriale pour s’assurer de la persistance d’une conduction atrioventriculaire systématique. Cette énergie est considérée plus sûre car son effet possède une certaine réversibilité a son arrêt. En cas de bloc atrioventriculaire, l’arrêt de la cryoablation permet le plus souvent une régression du trouble de conduction. Le taux de récidive est plus élevé qu’en radiofréquence, notamment si un écho persiste au décours de l’ablation. Avant de délivrer la cryoablation en tant que telle, certaines équipes réalisent un cryomapping sur le site d’ablation sélectionné. Il est refroidi qu’à -30°C pendant 60 s, générant des lésions complétement réversibles. Cela permet de s’assure de l’absence d’allongement de conduction atrioventriculaire avant de délivrer l’énergie de cryoablation.
Les risques de la procédure doivent être clairement exposés au patient, étant donné que son objectif est purement symptomatique. Le bloc atrioventriculaire complet est la complication principale. Il survient lorsque c’est la voie lente qui est atteinte par l’ablation. Il demeure très rare (0.2 – 0.8% des procédures),[6][9] mais il impose l’implantation d’un pacemaker à une population jeune qui le gardera plusieurs décennies et encourra donc un risque surajouté non négligeable de complications en lien avec le dispositif (occlusion veineuse, fracture de sonde, infection, etc.).
Le choix de la cryoablation permettra d’avoir un risque plus faible de bloc atrioventriculaire au prix d’un taux de récidive plus élevé.[5]
Les autres risques sont communs à toutes les procédures d’ablation endocavitaire : complication de voie d’abord (faux-anévrysme ou fistule) et tamponnade. Ils surviennent dans environ 0.2% des cas chaque.[5]
Il faut également prévenir les patients que même en cas de succès d’ablation, ils peuvent ressentir des palpitations dans les semaines qui suivent celle-ci. Elles sont dues essentiellement à des extrasystoles atriales ou ventriculaires mais finissent par régresser. On pourra véritablement juger du succès de l’ablation passé ce délai.
Références
- ↑ Katritsis DG, Josephson ME. Classification of electrophysiological types of atrioventricular nodal re-entrant tachycardia: a reappraisal. EP Eur. 2013 Sep;15(9):1231–40.
- ↑ Motté G, Dinanian S, Sebag C, Drieu L, Slama M. [Double responses]. Arch Mal Coeur Vaiss. 1995 Dec;88 Spec No 5:11–8.
- ↑ 3,0 3,1 et 3,2 Grolleau R, Gallay P. Arythmies cardiaques illustrées et expliquées. Montpellier: Sauramps médical; 2017.
- ↑ 4,0 et 4,1 Wu D, Denes P, Amat-Y-Leon F, Dhingra R, Wyndham CRC, Bauernfeind R, et al. Clinical, electrocardiographic and electrophysiologic observations in patients with paroxysmal supraventricular tachycardia. Am J Cardiol. 1978 May;41(6):1045–51.
- ↑ 5,0 5,1 5,2 5,3 et 5,4 Issa ZF, Miller JM, Zipes DP. 17 - Atrioventricular Nodal Reentrant Tachycardia. In: Issa ZF, Miller JM, Zipes DP, editors. Clinical Arrhythmology and Electrophysiology (Third Edition) [Internet]. Philadelphia: Elsevier; 2019. p. 560–98. Available from: https://www.sciencedirect.com/science/article/pii/B9780323523561000177
- ↑ 6,0 et 6,1 Brugada J, Katritsis DG, Arbelo E, Arribas F, Bax JJ, Blomström-Lundqvist C, et al. 2019 ESC Guidelines for the management of patients with supraventricular tachycardiaThe Task Force for the management of patients with supraventricular tachycardia of the European Society of Cardiology (ESC). Eur Heart J [Internet]. 2019 Aug 31 [cited 2019 Sep 1]; Available from: https://academic.oup.com/eurheartj/advance-article/doi/10.1093/eurheartj/ehz467/5556821
- ↑ Sacher F, Maury P. 3 - Troubles du rythme et ablation. In: Précis de Rythmologie. Stimuprat; 2022. p. 159–436.
- ↑ Katritsis DG, Sepahpour A, Marine JE, Katritsis GD, Tanawuttiwat T, Calkins H, et al. Atypical atrioventricular nodal reentrant tachycardia: prevalence, electrophysiologic characteristics, and tachycardia circuit. Europace. 2015 Jul;17(7):1099.1-1106.
- ↑ 9,0 et 9,1 Katritsis DG, Camm AJ. Atrioventricular Nodal Reentrant Tachycardia. Circulation. 2010 Aug 24;122(8):831–40.
- ↑ Dandamudi G, Mokabberi R, Assal C, Das MK, Oren J, Storm R, et al. A novel approach to differentiating orthodromic reciprocating tachycardia from atrioventricular nodal reentrant tachycardia. Heart Rhythm. 2010 Sep;7(9):1326–9.
- ↑ Maruyama M, Kobayashi Y, Miyauchi Y, Ino T, Atarashi H, Katoh T, et al. The VA Relationship After Differential Atrial Overdrive Pacing: A Novel Tool for the Diagnosis of Atrial Tachycardia in the Electrophysiologic Laboratory. J Cardiovasc Electrophysiol. 2007 Nov;18(11):1127–33.
- ↑ Appelboam A, Reuben A, Mann C, Gagg J, Ewings P, Barton A, et al. Postural modification to the standard Valsalva manoeuvre for emergency treatment of supraventricular tachycardias (REVERT): a randomised controlled trial. The Lancet. 2015 Oct;386(10005):1747–53.
- ↑ Jackman WM, Beckman KJ, McClelland JH, Wang X, Friday KJ, Roman CA, et al. Treatment of Supraventricular Tachycardia Due to Atrioventricular Nodal Reentry by Radiofrequency Catheter Ablation of Slow-Pathway Conduction. N Engl J Med. 1992 Jul 30;327(5):313–8.
- ↑ Haissaguerre M, Gaita F, Fischer B, Commenges D, Montserrat P, d’Ivernois C, et al. Elimination of atrioventricular nodal reentrant tachycardia using discrete slow potentials to guide application of radiofrequency energy. Circulation. 1992 Jun;85(6):2162–75.