L'intelligence artificielle et l'ECG
Introduction
L’intelligence artificielle (IA) est aujourd’hui omniprésente. Elle a déjà fait couler beaucoup d’encre car on l’imagine capable de concurrencer l’intelligence humaine avec une capacité à raisonner, à résoudre des énigmes, à porter des jugements, à planifier, à apprendre et à communiquer. Elle s’apparente en réalité aujourd’hui à une algorithmie évoluée capable de répondre de manière très précise à des problématiques bien définies. En rythmologie, les algorithmes de lecture d’ECG ou de gestion des alertes de télémétrie existent depuis longtemps avec des résultats imparfaits. Le développement de nouveaux algorithmes basés sur le machine learning et le deep learning est une révolution permettant de diminuer drastiquement le nombre d’erreurs, même s’ils sont difficilement explicables.
Intelligence artificielle, machine learning, deep learning : définitions et mode de fonctionnement.
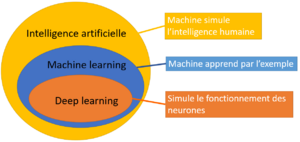
L’intelligence artificielle est définie par une machine qui simule l’intelligence humaine. Un simple thermostat entre dans le cadre de cette définition : il enclenche le chauffage seul de manière intelligente, il simule donc l’intelligence humaine. Les débuts de l’IA se situent dans les années 1950.
2 types d’IA existent :
-les algorithmes supervisés. Dans ce premier cas, on donne à l’algorithme des données d’entrées qui vont servir à prédire une donnée de sortie connue. Il s’agit principalement des analyses en régression qui sont couramment utilisées en statistique médicale pour prédire un événement (ex : données d’entrée = base, donnée de sortie = la mortalité ou l’hospitalisation) ou des algorithmes de machine learning (ex : donnée d’entrée = ECG, donnée de sortie = donnée étiquetée par un médecin = flutter).
-les algorithmes non supervisés. Dans ce deuxième cas, on donne des données à l’algorithme sans aucune « explication supplémentaire ». Il n’y a donc pas de donnée de sortie a priori. L’objectif ici est que l’algorithme trouve des groupes de patients ou de variables qui se ressemblent pour le plus souvent décrire différents phénotypes d’une maladie (qui n’auraient pas été décrits jusqu’alors). On tente ensuite de valider si ces groupes de patients ont du sens et notamment s’ils sont reliés à un quelconque pronostic ou mécanisme physiopathologique. Il s’agit de l’analyse en composante principale ou analyse en cluster.
Quelques années après la première description de l’IA naît le concept de machine learning qui est une machine capable d’apprendre seule d’après des exemples. Dans le language courant, lorsque nous parlons d’IA, nous pensons « machine learning ». Les réseaux neuronaux dont le deep learning (réseaux neuronaux constitués de plusieurs couches de neurones) sont une sous-catégorie de machine learning qui simule le fonctionnement des neurones. Cette technique s’est révélée être l’un des algorithmes les plus puissants de machine learning notamment dans la reconnaissance d’image ou la possibilité de battre le champion du monde au jeu de Go. (figure 1.)
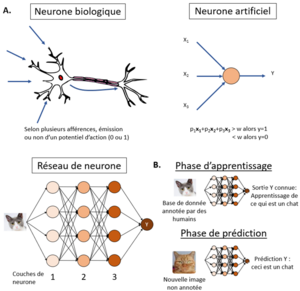
Les réseaux de neurones simulent le fonctionnement d’un neurone humain : dans un neurone biologique, il y a plusieurs afférences provenant d’autres neurones et le neurone qui reçoit toutes ces informations va en faire la synthèse sous la forme d’une seule efférence : potentiel d’action ou son absence (réponse en 0 ou 1). Dans un neurone artificiel, le fonctionnement est similaire : il y a plusieurs afférences en 0 ou 1 qui vont être pondérées par un facteur p, si la somme de toutes ces afférences est supérieure à une valeur seuil w, alors l’efférence est 1 sinon elle est de 0. Un réseau de neurone est la somme de plusieurs couches de neurones. Le réseau de neurone profond ou « deep learning » est un réseau avec de nombreuses couches de neurones qui deviennent capables d’extraire les caractéristiques fondamentales permettant de reconnaitre un objet sans avoir expliqué à l’algorithme ces caractéristiques à l’algorithme. (L’algorithme trouve tout seul que pour reconnaitre un chat, il faut reconnaitre des oreilles pointues, un certain éloignement des yeux, un nez triangulaire…). (figure 2A) Les réseaux de neurones profonds sont devenus possibles depuis l’amélioration des capacités de calcul et l’explosion du big data vers 2010.[1]
Pour créer un algorithme de machine learning, il y a une phase d’apprentissage sur une base de données la plus large possible et annotée par l’humain (algorithme supervisé). Il y a ensuite une phase de prédiction sur une deuxième base de données également annotée par l’humain cette fois ci pour valider que l’algorithme et donner sa performance. L’algorithme peut alors être utilisé en situation réelle. (Figure 2B)
L'IA en rythmologie
L’IA peut être utilisée dans différents champs :
-la prédiction du risque : la prédiction du risque d’AVC dans la FA via une score validé de CHADS2VASC2 par une simple régression. [2]
-la gestion des notifications : les alertes de télécardiologie de suivi de pace maker sont triées de manières intelligente via des règles de rappels voir des algorithmes de deep-learning permettant de reclasser des évènements comme la survenue de FA avec plus de précision comme le fait la start-up française Implicity. [3]
-les mesures/reconnaissance automatique : les outils de cartographies ultra-haute densité enregistrent des dizaines de milliers de points d’activation électrique intra-cavitaire en quelques minutes via plusieurs algorithmes d’intelligence artificielle. La start-up française Volta utilise des algorithmes de deep-learning pour reconnaitre les enregistrements endocavitaires pathologiques et ainsi mieux cibler les zones à traiter dans les oreillettes fibrillatoires.[4] Cette technologie est en cours de validation.
-le diagnostic : l’interprétation automatique de l’électrocardiogramme en est l’exemple le plus prometteur. En effet, le caractère très simple et non invasif d’un enregistrement électrique cardiaque le rend candidat idéal à la fois pour l’injecter dans des algorithmes d’intelligence artificielle mais également comme outil de dépistage massif aujourd’hui limité par le besoin en ressource humaine pour l’interprétation. Concernant l’Holter-ECG, la start-up française Cardiologs utilise des algorithmes de deep-learning pour faciliter le tri et la lecture des épisodes et permet de gagner 42% de temps en moyenne lors de la lecture d’un Holter sans perdre en précision diagnostique.[5]
-la découverte de nouveaux phénotypes de maladies rythmologiques via les algorithmes non supervisés. [6]
-le diagnostic et le traitement des arythmies ventriculaires par les défibrillateurs automatiques implantables ou les gilets défibrillateurs.
Etat des lieux de l'intelligence artificielle pour l'ECG
Les dernières études sur l’interprétation de l’ECG par des algorithmes d’intelligence artificiel et notamment de réseaux neuronaux profonds montrent :
-une capacité diagnostique excellente voire supérieure à celle des cardiologues pour l’analyse des paramètres diagnostics classiques (troubles du rythme et de la conduction, morphologie cardiaque, Ischémie et péricardite, QT long, QT court, pré excitation, stimulation). [7][8]
-une bonne capacité de prédiction sur un ECG en rythme sinusal de la survenue de fibrillation atriale dans le mois qui suit, avec une AUC à 0.90. [9]
-la prédiction de l’âge avec une erreur moyenne de 6.9 ans et du sexe du patient avec une AUC à 0.97. [10]
-une capacité à dépister une fraction d’éjection ventriculaire gauche <35%, une dysfonction diastolique, une cardiomyopathie hypertrophique, une hypertension artérielle pulmonaire, une hypertrophie ventriculaire secondaire, une amylose et un prolapsus mitral avec des AUC respectivement de 0.93 ; 0.84 ; 0.96 ; 0.94 ; 0.87 ; 0.86 ; 0.77. [11][12][13]
-une capacité à prédire l’hyperkaliémie avec une AUC à 0.88. [14]
Ces capacités étonnantes de dépistage, pour certaines non accessibles à l’œil humain, ont été validées sur des cohortes de centaines de milliers voire de millions d'ECG suivies depuis plus de 20 ans et pour la majorité aux USA et en Asie. Etant donné les spécificités de ces populations, ces résultats ne sont pas transposables en l’état sur les populations européennes.
Il est aujourd’hui indispensable de développer des bases de données françaises ou européennes, en standardisant la méthode d’enregistrement et en centralisant les données numériques. Il est également nécessaire de valider l’utilité de ces algorithmes par des études randomisées sur des critères de jugement robustes. Certaines de ces études sont déjà en cours.
Une interprétation fiable et autonome entrainerait des bénéfices importants. Elle permettrait d’élargir la population ciblée, d’augmenter le nombre d’enregistrements par personne et de toucher les zones en déficit de ressources humaines médicales avec comme conséquences potentielles :
-une amélioration de la prédiction de la survenue de la mort subite en visualisant des anomalies électriques dynamiques soit asymptomatiques, soit lors de symptômes, qui sont fréquents dans les jours précédant la mort subite,
- une généralisation du dépistage des jeunes sportifs, en dépistant les canalopathies à risque de mort subite type QT court, QT long, syndrome de Brugada
-un dépistage des cardiopathies plus précoce avec pour incidence la diminution de leur morbi-mortalité
-une amélioration de la prédiction de la survenue des décompensations cardiaques afin d'éviter des hospitalisations
-un dépistage de la fibrillation atriale avec pour objectif de diminuer la morbi-mortalité liée à celle-ci et notamment les accidents vasculaires cérébraux.
Limites des réseaux neuronaux profonds (deep learning)
Les réseaux neuronaux profonds sont des algorithmes peu explicables, c’est-à-dire qu’ils arrivent au bon résultat la plupart du temps sans se tromper mais sans que nous comprenions vraiment comment (ce qui nous fait les assimiler à des « boites noires »). L’humain n’en tire pas d’information intelligible pour pouvoir établir de nouvelles connaissances structurées.
Lorsque les algorithmes de deep learning se trompent, les réponses peuvent être absurdes. Elle n’a pas de recul sur sa réponse tandis que l’humain peut corriger une interprétation erronée en fonction du contexte et de son expérience.
Les algorithmes de deep learning sont sensibles à la moindre variation des données d’entrées (1 seul pixel peut suffire). Il faut donc une qualité technique d’enregistrement irréprochable et standardisée.
Enfin, il y a un risque de biais systématique si la population cible est différente de la population de validation de l’algorithme ou que l’enregistrement est systématiquement fait de manière différente. Il est donc nécessaire d’avoir un regard critique humain permanent et de revalider les algorithmes fréquemment.[15]
Aspects légaux et acceptabilité.
Il y a une différence importante entre l’IA pour l’aide au diagnostic et l’IA autonome (sans supervision humaine). A ce jour, en rythmologie, seuls des algorithmes d’aide au diagnostic existent.
Une grille d’évaluation des dispositifs d’IA a été proposée par la Haute Autorité de Santé en 2020 pour donner un cadre aux acteurs souhaitant développer des algorithmes d’IA en médecine. Cela permet de standardiser les critères de qualité permettant à un algorithme d’IA d’être accepté comme dispositif médical avec un éventuel remboursement et donc de faciliter l’investissement dans ce domaine.
Il reste néanmoins beaucoup de chemin à parcourir sur le plan du droit avec notamment la problématique de la responsabilité civile (qui la porte : concepteur, fabriquant, utilisateur, médecin ?) mais également sur l’acceptation du corps médical d’une IA qui pourrait être vécue comme intrusive surtout si elle devient autonome.
Conclusion
L’IA a déjà inondé notre vie en rythmologie depuis longtemps. Les derniers algorithmes de machine learning permettent de drastiquement faire chuter les erreurs de l’IA et ainsi d’élargir le champ des possibles. La question n’est pas de savoir si l’IA va progressivement prendre plus de place mais plutôt de savoir comment l’intégrer au mieux dans notre pratique quotidienne pour le bien de tous.
Liens d’intérêt : aucun
Bibliographie
- ↑ David Louapre. Deep learning, science étonnante. 2016; Disponible sur: https://scienceetonnante.com/2016/04/08/le-deep-learning/
- ↑ Friberg L, Rosenqvist M, Lip GYH. Evaluation of risk stratification schemes for ischaemic stroke and bleeding in 182 678 patients with atrial fibrillation: the Swedish Atrial Fibrillation cohort study. Eur Heart J. juin 2012;33(12):1500‑10.
- ↑ Mittal S, Oliveros S, Li J, Barroyer T, Henry C, Gardella C. AI Filter Improves Positive Predictive Value of Atrial Fibrillation Detection by an Implantable Loop Recorder. JACC Clin Electrophysiol. août 2021;7(8):965‑75.
- ↑ Aksu T, Guler TE, Bozyel S, Yalin K. Usage of a new mapping algorithm to detect possible critical substrate for continuity of atrial fibrillation: fractionation mapping in preliminary experience. J Interv Card Electrophysiol Int J Arrhythm Pacing. juin 2020;58(1):29‑34.
- ↑ Fiorina L, Marijon E, Maupain C, Coquard C, Larnier L, Rischard J, et al. 222AI-based strategy enables faster Holter ECG analysis with equivalent clinical accuracy compared to a classical strategy. EP Eur. 1 juin 2020;22(Supplement_1):euaa162.374.
- ↑ Inohara T, Shrader P, Pieper K, Blanco RG, Thomas L, Singer DE, et al. Association of of Atrial Fibrillation Clinical Phenotypes With Treatment Patterns and Outcomes: A Multicenter Registry Study. JAMA Cardiol. 1 janv 2018;3(1):54‑63.
- ↑ Kashou. AH. A comprehensive artificial intelligence–enabled electrocardiogram interpretation program. Cardiovasc Digit Health J. 1 sept 2020;1(2):62‑70.
- ↑ Zhu H, Cheng C, Yin H, Li X, Zuo P, Ding J, et al. Automatic multilabel electrocardiogram diagnosis of heart rhythm or conduction abnormalities with deep learning: a cohort study. Lancet Digit Health. juill 2020;2(7):e348‑57.
- ↑ Attia ZI, Noseworthy PA, Lopez-Jimenez F, Asirvatham SJ, Deshmukh AJ, Gersh BJ, et al. An artificial intelligence-enabled ECG algorithm for the identification of patients with atrial fibrillation during sinus rhythm: a retrospective analysis of outcome prediction. Lancet Lond Engl. 7 sept 2019;394(10201):861‑7.
- ↑ Attia ZI, Friedman PA, Noseworthy PA, Lopez-Jimenez F, Ladewig DJ, Satam G, et al. Age and Sex Estimation Using Artificial Intelligence From Standard 12-Lead ECGs. Circ Arrhythm Electrophysiol. sept 2019;12(9):e007284.
- ↑ Tison GH, Zhang J, Delling FN, Deo RC. Automated and Interpretable Patient ECG Profiles for Disease Detection, Tracking, and Discovery. Circ Cardiovasc Qual Outcomes. sept 2019;12(9):e005289.
- ↑ Ko WY, Siontis KC, Attia ZI, Carter RE, Kapa S, Ommen SR, et al. Detection of Hypertrophic Cardiomyopathy Using a Convolutional Neural Network-Enabled Electrocardiogram. J Am Coll Cardiol. 25 févr 2020;75(7):722‑33.
- ↑ Adedinsewo D, Carter RE, Attia Z, Johnson P, Kashou AH, Dugan JL, et al. Artificial Intelligence-Enabled ECG Algorithm to Identify Patients With Left Ventricular Systolic Dysfunction Presenting to the Emergency Department With Dyspnea. Circ Arrhythm Electrophysiol. 1 août 2020;13(8):e008437.
- ↑ Galloway CD, Valys AV, Shreibati JB, Treiman DL, Petterson FL, Gundotra VP, et al. Development and Validation of a Deep-Learning Model to Screen for Hyperkalemia From the Electrocardiogram. JAMA Cardiol. 1 mai 2019;4(5):428‑36.
- ↑ Schläpfer J, Wellens HJ. Computer-Interpreted Electrocardiograms: Benefits and Limitations. J Am Coll Cardiol. 29 août 2017;70(9):1183‑92.